Pendahuluan
Menavigasi lanskap regulasi untuk alat kesehatan di Indonesia semakin ketat dalam beberapa tahun terakhir. Banyak distributor dan produsen terkejut mendapati permohonan registrasi produk mereka ditolak atau ditunda karena mereka tidak memiliki sertifikasi khusus yang dikenal sebagai CDAKB. Pada tahun-tahun sebelumnya, memegang izin distribusi (IDAK) sudah cukup. Namun, Kementerian Kesehatan Indonesia (Kemenkes) kini secara ketat menegakkan penerapan standar Praktik Distribusi yang Baik untuk memastikan keamanan produk dari gudang hingga pasien. Memahami dan memperoleh CDAKB bukan lagi pilihan; ini merupakan persyaratan penting untuk keberlangsungan bisnis.
2. Tentang INSIGHTOF Consulting
Kami adalah INSIGHTOF Consulting Indonesia, sebuah firma urusan regulasi yang berdedikasi dan mengkhususkan diri dalam sertifikasi Alat Kesehatan, Kosmetik, Makanan, dan Halal. Kami memahami bahwa peralihan dari perizinan sederhana ke sistem jaminan mutu yang komprehensif dapat membingungkan bagi bisnis. Tim kami menyediakan bantuan menyeluruh, mulai dari analisis kesenjangan awal hingga penerbitan akhir CDAKB Anda.
3. Memahami CDAKB: Panduan Komprehensif
3.1 Apa itu CDAKB?
CDAKB adalah singkatan dari Cara Distribusi Alat Kesehatan yang Baik, yang berarti Praktik Distribusi yang Baik untuk Alat Kesehatan. Ini adalah sistem sertifikasi yang didirikan oleh Kementerian Kesehatan Indonesia untuk memastikan bahwa alat kesehatan diperoleh, disimpan, ditangani, dan didistribusikan dengan cara yang menjaga kualitas, keamanan, dan kinerjanya.
Meskipun izin distribusi (IDAK) memberikan hak hukum untuk beroperasi sebagai distributor, sertifikat CDAKB membuktikan bahwa prosedur operasional Anda sesuai dengan standar kualitas internasional. Sertifikat ini mencakup setiap aspek rantai pasokan, termasuk kompetensi personel, fasilitas gudang, manajemen rantai dingin, dan pengawasan pasca-pemasaran.

3.2 Mengapa CDAKB Kini Wajib
Sebelumnya, CDAKB merupakan standar sukarela. Namun, pembaruan peraturan terbaru telah mengintegrasikan CDAKB ke dalam persyaratan untuk memperoleh dan memperbarui Izin Pemasaran (Izin Edar).
- Prasyarat untuk Registrasi Produk: Sistem registrasi online (REGALKES) seringkali memerlukan bukti implementasi CDAKB sebelum mengizinkan pengajuan produk baru.
- Perpanjangan Lisensi: Distributor tidak dapat memperbarui IDAK (Lisensi Distribusi) mereka tanpa sertifikat CDAKB yang valid.
- Jaminan Mutu: Ini memastikan bahwa perangkat sensitif, seperti reagen IVD atau peralatan elektromekanik, tidak rusak selama penyimpanan atau pengangkutan.
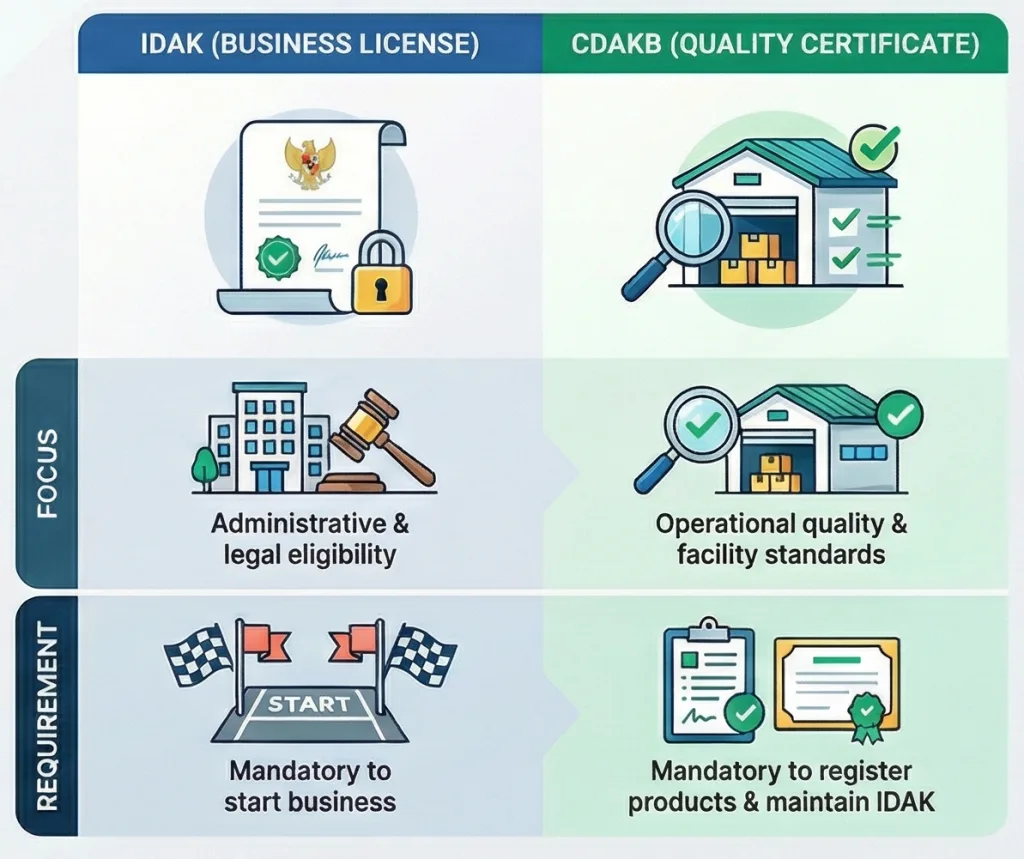
3.3 IDAK vs. CDAKB: Apa Perbedaannya?
Penting untuk membedakan antara izin usaha dan sertifikasi mutu. Silakan lihat tabel di bawah ini untuk perbandingan yang jelas.
| Feature | IDAK (Izin Distribusi Alat Kesehatan) | CDAKB (Cara Distribusi Alat Kesehatan yang Baik) |
| Definisi | Izin usaha yang memberikan wewenang kepada perusahaan untuk mendistribusikan alat-alat medis. | Sertifikat yang membuktikan penerapan Sistem Manajemen Mutu dalam distribusi. |
| Fokus | Kelayakan administratif dan hukum. | Kualitas operasional, SOP, dan standar fasilitas. |
| Jenis Audit | Peninjauan administratif dan kunjungan lapangan dasar. | Audit langsung yang ketat terhadap proses, catatan, dan fasilitas di lokasi. |
| Validity | 5 Tahun. | 5 Tahun (tergantung pada audit pengawasan). |
| Persyaratan | Wajib untuk memulai bisnis. | Wajib mendaftarkan produk dan memelihara IDAK. |
3.4 Key Aspects of the CDAKB Audit
Untuk mendapatkan sertifikasi, perusahaan Anda harus menjalani audit oleh petugas Kemenkes. Mereka akan memeriksa beberapa aspek penting:
- Tanggung Jawab Manajemen: Komitmen dari manajemen puncak untuk menjaga kualitas.
- Manajemen Sumber Daya: Kompetensi Penanggung Jawab Teknis (PJT) dan catatan pelatihan staf.
- Aktivitas Rantai Pasokan: SOP untuk pengadaan, penerimaan, penyimpanan, dan pengiriman.
- Ketelusuran: Kemampuan untuk melacak produk dari produsen hingga pengguna akhir, terutama untuk penarikan produk.
- Manajemen Fasilitas: Catatan pemantauan suhu, pengendalian hama, dan kebersihan.
- FSCA (Tindakan Korektif Keselamatan Lapangan): Prosedur untuk menangani keluhan dan penarikan produk.
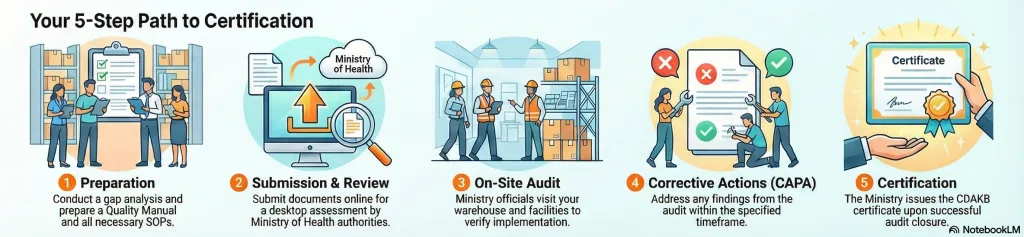
3.5 The Certification Process Steps
Proses menuju CDAKB melibatkan beberapa tahapan yang memerlukan persiapan yang cermat:
- Analisis Kesenjangan: Menilai fasilitas dan SOP saat ini terhadap standar CDAKB.
- Persiapan Dokumen: Membuat Manual Mutu dan Prosedur Operasi Standar (SOP) yang terperinci.
- Pengajuan Online: Mengajukan permohonan melalui portal Kementerian Kesehatan.
- Penilaian Desktop: Evaluator meninjau dokumen yang diajukan.
- Audit di Lokasi: Auditor mengunjungi gudang untuk memverifikasi implementasi.
- CAPA (Tindakan Korektif dan Pencegahan): Menangani temuan dari audit dalam jangka waktu tertentu.
- Penerbitan: Kementerian menerbitkan sertifikat CDAKB setelah penutupan CAPA yang berhasil.
4. Frequently Asked Questions (FAQ)
Q: Perusahaan saya adalah produsen luar negeri. Apakah saya memerlukan CDAKB?
A: Tidak, CDAKB berlaku untuk entitas Indonesia yang mendistribusikan produk tersebut. Namun, distributor atau pemegang lisensi lokal Anda di Indonesia harus memiliki sertifikasi ini.
Q: Bisakah kami mengajukan pendaftaran produk (Izin Edar) jika CDAKB kami masih dalam proses?
A: Dalam beberapa kasus, tanda terima pengajuan CDAKB dapat diterima sementara, tetapi memiliki sertifikat lengkap diperlukan untuk kepatuhan jangka panjang dan proses perpanjangan yang lancar.
Q: Apa yang terjadi jika kita gagal dalam audit?
A: Anda akan menerima daftar temuan (minor, mayor, atau kritis). Anda harus menerapkan tindakan korektif (CAPA) dan menyerahkan bukti perbaikan tersebut. Jika temuan kritis tidak ditangani, sertifikasi akan ditolak.
Q: Apakah CDAKB berlaku untuk semua kelas risiko perangkat medis?
A: Ya, ini berlaku untuk semua distributor, tetapi kompleksitas persyaratannya meningkat seiring dengan risiko produk (misalnya, persyaratan rantai dingin untuk reagen IVD lebih ketat daripada untuk perabot rumah sakit).
Achieve CDAKB Compliance with INSIGHTOF

725 / 5,000
Persiapan audit Kementerian Kesehatan bisa sangat menegangkan tanpa bimbingan yang tepat. INSIGHTOF Consulting Indonesia menawarkan paket dukungan komprehensif untuk memastikan Anda lulus audit CDAKB dengan percaya diri.
![]() Pengembangan SOP: Kami membantu dalam menyusun dan menyempurnakan Manual Mutu dan Prosedur Operasi Standar Anda agar memenuhi standar regulasi.
Pengembangan SOP: Kami membantu dalam menyusun dan menyempurnakan Manual Mutu dan Prosedur Operasi Standar Anda agar memenuhi standar regulasi.
![]() Audit Simulasi: Para ahli kami melakukan audit simulasi untuk mengidentifikasi masalah ketidakpatuhan sebelum inspektur Kemenkes resmi tiba.
Audit Simulasi: Para ahli kami melakukan audit simulasi untuk mengidentifikasi masalah ketidakpatuhan sebelum inspektur Kemenkes resmi tiba.
![]() Kami membimbing Penanggung Jawab Teknis (PJT) Anda tentang cara menjawab pertanyaan auditor secara efektif.
Kami membimbing Penanggung Jawab Teknis (PJT) Anda tentang cara menjawab pertanyaan auditor secara efektif.
![]() Bantuan CAPA: Jika ditemukan kesalahan, kami membantu merumuskan dan mendokumentasikan tindakan korektif yang diperlukan untuk menutup audit dengan sukses.
Bantuan CAPA: Jika ditemukan kesalahan, kami membantu merumuskan dan mendokumentasikan tindakan korektif yang diperlukan untuk menutup audit dengan sukses.
Kesimpulan
CDAKB bukan lagi sekadar tanda keunggulan; ini adalah lisensi mendasar untuk beroperasi di pasar alat kesehatan Indonesia. Mengabaikan persyaratan ini dapat menyebabkan terhentinya registrasi produk dan ketidakmampuan untuk memperbarui lisensi distribusi. Dengan membangun sistem manajemen mutu yang kuat sekarang, Anda melindungi bisnis Anda dari gangguan regulasi dan menunjukkan komitmen Anda terhadap keselamatan pasien. Bermitra dengan INSIGHTOF Consulting untuk menavigasi proses yang kompleks ini secara efisien.
Jika Anda membutuhkan bantuan ahli terkait sertifikasi CDAKB atau registrasi alat kesehatan Anda, silakan hubungi kami untuk konsultasi.
#CDAKB #GoodDistributionPractice #MedicalDeviceIndonesia #IzinEdarAlkes #Kemenkes #AlatKesehatan #RegulatoryAffairsIndonesia #MedicalDeviceDistributor #IDAK #QualityManagementSystem #IndonesianHealthRegulation #MedicalDeviceConsultant #ISO13485 #GDP #INSIGHTOF







