INSIGHTOF telah mendukung perusahaan kosmetik, alat kesehatan, dan produk kesehatan di Indonesia sejak tahun 2016. Dengan lebih dari 1.000 registrasi BPOM, Halal, dan alat kesehatan yang telah diproses, tim kami membantu memastikan bahwa produk sepenuhnya mematuhi persyaratan regulasi Indonesia.
Pengalaman 10 Tahun / Pakar Konsultasi Sertifikasi / Berbasis di Jakarta
Selama konsultasi baru-baru ini, banyak perusahaan kosmetik mengajukan pertanyaan serupa:
- “Kami telah menjual produk pemutih atau anti-penuaan selama bertahun-tahun. Mengapa BPOM baru sekarang menanyakan tentang uji klinis?”
- “Apakah kami benar-benar membutuhkan persetujuan etik hanya untuk menguji produk kosmetik?”
Kekhawatiran ini dapat dimengerti.
Dengan diterbitkannya Peraturan BPOM Nomor 34 Tahun 2025, BPOM secara resmi memperkuat kerangka kerja untuk uji klinis kosmetik, khususnya untuk produk dengan klaim spesifik, bahan inovatif, atau risiko keamanan yang lebih tinggi.
Peraturan ini mencerminkan komitmen BPOM terhadap evaluasi berbasis bukti ilmiah, memastikan bahwa klaim kosmetik terkait keamanan dan manfaat valid secara ilmiah dan dilakukan secara etis.
Jika data pendukung dalam Dokumen Informasi Produk (DIP) Anda tidak mencukupi atau tidak sesuai, proses pemberitahuan dapat tertunda atau dipertanyakan selama audit atau pengawasan pasca-pemasaran.
Persetujuan Etika: Kapan Diperlukan?
Salah satu klarifikasi terpenting dalam peraturan ini berkaitan dengan persetujuan etik.
Jika uji klinis baru dilakukan di Indonesia, maka persetujuan etik wajib diperoleh sebelum uji klinis dimulai. Persyaratan ini berlaku untuk produk lokal maupun impor. Untuk produk berisiko tinggi seperti kosmetik yang mengandung bahan pemutih tertentu, bahan nano, klaim anti-penuaan, klaim SPF, atau produk yang diaplikasikan pada area sensitif, persetujuan harus diperoleh dari Komite Etik independen.
Persetujuan etik luar negeri yang sudah ada tidak dapat menggantikan persetujuan etik Indonesia untuk uji klinis baru yang dilakukan di Indonesia.
Bisakah Produk Impor Menggunakan Data Uji Klinis Luar Negeri yang Sudah Ada?
Ini tidak berarti bahwa semua produk impor harus mengulang uji klinis di Indonesia.
Untuk produk kosmetik impor, termasuk dari Korea, data uji klinis luar negeri yang sudah ada masih dapat digunakan jika semua kondisi berikut terpenuhi:
- Uji klinis telah mendapatkan persetujuan etik yang tepat
- Komite Etik diidentifikasi dengan jelas
- Persetujuan informed consent diperoleh dari semua subjek
- Metodologi valid secara ilmiah
- Klaim yang digunakan di Indonesia sama dengan, atau lebih konservatif daripada, klaim yang didukung oleh uji klinis
Dalam situasi ini, data uji klinis yang sudah ada dapat digunakan, dan tidak diperlukan persetujuan etik baru atau pengulangan uji klinis di Indonesia.
Namun, masalah muncul ketika uji klinis yang sudah ada tidak mendukung klaim yang dimaksud. Misalnya, jika serum hanya memiliki data klinis yang mendukung hidrasi, tetapi merek tersebut berencana untuk menggunakan klaim pemutihan atau anti-penuaan di Indonesia, data tersebut dianggap tidak mencukupi. Dalam kasus seperti itu, hanya ada dua pilihan yang sesuai:
- menyesuaikan klaim agar sesuai dengan data yang tersedia, atau melakukan uji klinis baru.
- Jika uji klinis baru dilakukan di Indonesia, persetujuan etik harus diperoleh sebelum uji coba dimulai.
Apakah Uji Klinis Baru Selalu Membutuhkan Persetujuan Etika dari Badan Etika Indonesia?
👉 YA, jika uji coba dilakukan di Indonesia.
Berdasarkan Peraturan BPOM Nomor 34 Tahun 2025:
- Semua uji klinis yang dilakukan di Indonesia harus mendapatkan persetujuan etik SEBELUM dimulai.
- Ini berlaku untuk produk lokal dan impor.
- Produk berisiko tinggi (misalnya, agen pemutih, bahan nano, klaim anti-penuaan) memerlukan persetujuan Komite Etik independen.
Persetujuan etik luar negeri yang sudah ada tidak dapat menggantikan persetujuan etik Indonesia untuk uji klinis baru.
Pembaruan Regulasi dalam Peraturan BPOM No.34 Tahun 2025

Peraturan BPOM No. 34 Tahun 2025 mengubah Peraturan BPOM No. 8 Tahun 2024 tentang Prosedur Persetujuan Uji Klinis (PPUK) dengan memperkenalkan ketentuan khusus dan mengikat untuk uji klinis kosmetik.
Ketentuan baru, Pasal 5 ayat (3a), secara eksplisit menyatakan bahwa uji klinis kosmetik harus mengikuti Pedoman Uji Klinis Kosmetik yang tercantum dalam Lampiran IIIa, yang merupakan bagian tak terpisahkan dari peraturan ini. Uji klinis kosmetik tidak lagi dipandu oleh praktik informal. Metodologi harus valid, dipublikasikan, dibenarkan secara ilmiah, dan etis, dengan keselamatan subjek sebagai prioritas utama.
Peraturan ini juga memperkenalkan klasifikasi uji klinis kosmetik berdasarkan risiko. Produk berisiko tinggi meliputi produk anti-penuaan, produk SPF, kosmetik dengan bahan nano atau agen pemutih khusus, produk yang diaplikasikan pada area sensitif, uji iritasi atau sensitisasi, uji fototoksisitas, dan produk yang melibatkan kelompok rentan atau paparan jangka panjang. Produk berisiko rendah umumnya meliputi pelembap dasar, pembersih, dan produk dengan bahan-bahan yang sudah mapan dan dampak fisiologis minimal.
Untuk uji klinis berisiko tinggi, persetujuan dari Komite Etika independen adalah wajib. Untuk uji klinis berisiko rendah, persetujuan etika dapat diperoleh dari Komite Etika Internal, asalkan persyaratan peraturan terpenuhi. Klasifikasi risiko yang salah dapat menyebabkan penolakan selama tinjauan etika atau ketika BPOM mengevaluasi DIP.
Gambaran Umum Klasifikasi Risiko
| Aspek | Uji Coba Kosmetik Berisiko Tinggi | Uji Coba Kosmetik Berisiko Rendah |
|---|---|---|
| Area Aplikasi | Area sensitif (mata, selaput lendir, area genital) | Area kulit secara umum |
| Bahan-bahan | Nanomaterial, agen pemutih kulit spesifik, bahan-bahan yang belum teruji | Ingredients with established safety data |
| Jenis Tes | Iritasi, sensitisasi, fototoksisitas, pengujian SPF | Minimal-risk efficacy testing |
| Jenis Produk | Produk anti-penuaan, produk SPF | Basic moisturizers, cleansers |
| Subjek Sasaran | Kelompok rentan, paparan jangka panjang | Healthy adults, short-term exposure |
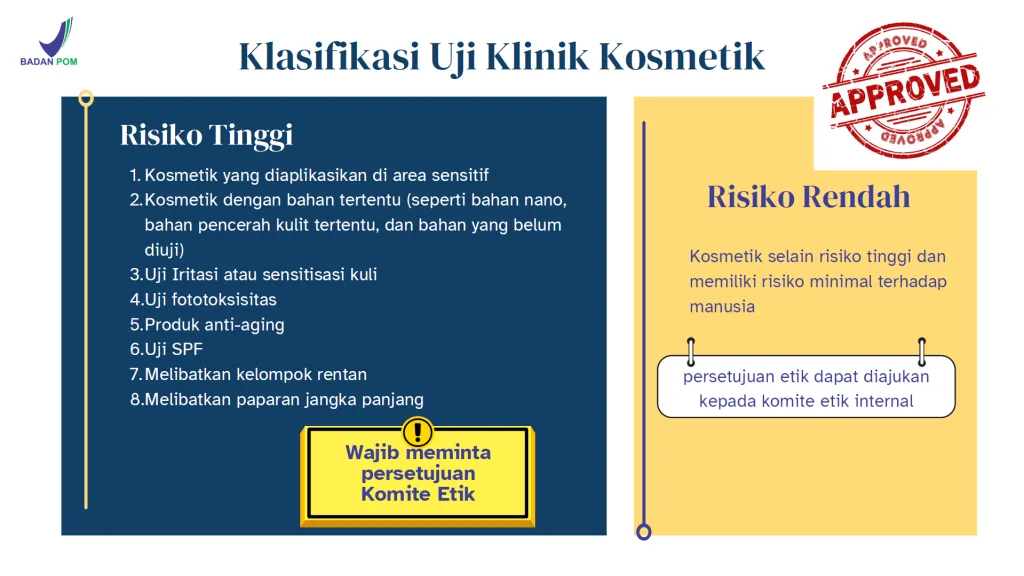
Konsekuensi regulasi:
- Uji klinis berisiko tinggi → Persetujuan dari Komite Etika independen wajib hukumnya
- Uji coba berisiko rendah → Persetujuan etika dapat diperoleh dari Komite Etika Internal, asalkan persyaratan terpenuhi.
 Persetujuan Etika Harus Diperoleh Sebelum Percobaan Dilakukan
Persetujuan Etika Harus Diperoleh Sebelum Percobaan Dilakukan
Pasal 6 dan Pasal 7 yang telah diamandemen memperjelas bahwa:
- Persetujuan etik harus diperoleh sebelum uji klinis dimulai.
- Persetujuan informed consent harus ditandatangani sebelum intervensi apa pun dilakukan.
- Tidak ada aktivitas uji coba yang diizinkan sebelum persetujuan etik dikeluarkan.
Melakukan uji coba terlebih dahulu dan meminta persetujuan etik setelahnya dilarang keras.
Ini melindungi:
- Hak subjek penelitian
- Keamanan subjek penelitian
- Integritas data dan validitas ilmiah
 Bagaimana Data Uji Klinis Digunakan
Bagaimana Data Uji Klinis Digunakan
Hasil uji klinis digunakan untuk mendukung klaim kosmetik, memberikan bukti keamanan dan manfaat, serta memenuhi bagian Keamanan dan Manfaat dari Dokumen Informasi Produk (DIP). DIP tidak diunggah selama pemberitahuan kosmetik, tetapi harus lengkap dan siap jika terjadi audit BPOM, pengambilan sampel produk, atau pengawasan pasca-pemasaran.
Jika bukti klinis atau dokumentasi etika hilang atau tidak sesuai, BPOM dapat mempertanyakan klaim tersebut, meminta revisi, atau mengambil tindakan regulasi setelah persetujuan pemberitahuan.
Aturan Sederhana yang Harus Diingat
Klaim yang lebih tinggi = tanggung jawab yang lebih tinggi
Jika klaim kosmetik Anda kuat,
bukti ilmiah Anda juga harus sama kuatnya.
Pertanyaan yang Sering Diajukan (FAQ)
Q: Apakah semua produk kosmetik memerlukan Persetujuan Uji Klinis BPOM?
A: Tidak. Untuk kosmetik, uji klinis diperlukan jika dibutuhkan untuk membuktikan klaim keamanan atau manfaat, terutama untuk produk berisiko tinggi atau klaim inovatif. Namun, uji klinis kosmetik yang dilakukan di Indonesia tetap harus mengikuti standar etika dan prosedur dalam peraturan ini.
T: Uji klinis kami selesai sebelum tahun 2025 tanpa merujuk pada Lampiran IIIa. Apakah masih berlaku?
J: Tergantung.
Meskipun peraturan ini baru, prinsip-prinsip validitas ilmiah dan etika penelitian selalu berlaku. Jika uji klinis tersebut tidak memiliki metodologi yang tepat, persetujuan etika, atau persetujuan berdasarkan informasi, BPOM dapat menolaknya sebagai bukti pendukung yang valid dalam DIP. Tinjauan regulasi sangat disarankan.
T: Produk kami sudah memiliki uji klinis dari luar negeri. Bisakah kami menggunakannya?
J: Ya, terkadang.
Data uji klinis luar negeri dapat digunakan jika data tersebut etis, valid secara ilmiah, dan mendukung klaim yang sama atau lebih ringan yang digunakan di Indonesia.
Bagaimana INSIGHTOF Dapat Membantu Anda
INSIGHTOF mendukung pendaftaran kosmetik di Indonesia dengan membantu merek memahami apakah klaim produk mereka sudah didukung oleh data yang mereka miliki.

Tinjau data uji klinis Anda yang sudah ada
- Periksa apakah klaim Anda sesuai dengan bukti yang tersedia
- Identifikasi potensi risiko regulasi sejak dini
- Beritahu apakah Anda perlu menyesuaikan klaim atau menyiapkan data pendukung tambahan
- Dengan cara ini, Anda dapat menghindari penundaan yang tidak perlu, revisi klaim, atau masalah selama audit BPOM dan pengawasan pasca-pemasaran.
Jika Anda tidak yakin apakah data produk Anda cukup, jangan menebak.
Biarkan para ahli regulasi meninjaunya terlebih dahulu—agar Anda dapat mendaftarkan produk Anda dengan percaya diri.
Kepatuhan terhadap peraturan bukanlah soal menebak atau membuat asumsi. Setiap produk harus dinilai berdasarkan kasus per kasus, berdasarkan klaim, bahan, dan data yang tersedia.








